ORGOVYX 120 mg, comprimé pelliculé, boîte de 1 flacon de 30
Dernière révision : 18/11/2024
Taux de TVA : 2.1%
Prix de vente : 89,48 €
Taux remboursement SS : 100%
Base remboursement SS : 89,48 €
Laboratoire exploitant : ACCORD HEALTHCARE FRANCE
Orgovyx est indiqué dans le traitement des patients adultes atteints d'un cancer de la prostate avancé hormonodépendant.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Effet sur l'intervalle QT/QTc
Un traitement par suppression androgénique est susceptible d'être à l'origine d'un allongement de l'intervalle QT.
Chez les patients présentant des antécédents ou des facteurs de risque
d'allongement de l'intervalle QT et chez les patients recevant un
traitement concomitant susceptible d'allonger l'intervalle QT (voir
rubrique Interactions avec d'autres médicaments et autres formes d'interactions),
les médecins doivent évaluer le rapport bénéfice/risque, incluant le
risque de torsades de pointes, avant l'instauration du traitement par
Orgovyx.
Une étude approfondie sur l'intervalle QT/QTc a montré l'absence d'effet intrinsèque du rélugolix sur l'allongement de l'intervalle QTc (voir rubrique Effets indésirables).
Maladies cardiovasculaires
Des maladies cardiovasculaires, comme les infarctus du myocarde ou les accidents vasculaires cérébraux, ont été décrits dans la littérature médicale chez des patients traités par suppression androgénique. Par conséquent, tout facteur de risque cardiovasculaire doit être pris en considération.
Modification de la densité osseuse
La diminution à long terme de la production de testostérone chez les hommes ayant subi une orchidectomie ou ayant été traités par un agoniste de la GnRH ou par un antagoniste de la GnRH est associée à une diminution de la densité osseuse. Chez les patients présentant des facteurs de risque additionnels, la diminution de la densité osseuse peut conduire à une ostéoporose avec un risque accru de fractures osseuses.
Insuffisance hépatique
Les essais cliniques à long terme du rélugolix n'ont pas inclus de patients ayant ou suspectés d'avoir une insuffisance hépatique. Des élévations légères et transitoires des alanine aminotransférases (ALAT) et des aspartate aminotransférases (ASAT) ont été observées, mais elles n'étaient pas associées à une augmentation de la bilirubine ou à une symptomatologie clinique (voir rubrique Effets indésirables). Chez les patients ayant ou suspectés d'avoir une insuffisance hépatique, une surveillance de la fonction hépatique est recommandée durant le traitement. La pharmacocinétique du rélugolix n'a pas été évaluée chez les patients présentant une insuffisance hépatique sévère (voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale sévère
L'exposition au rélugolix peut être multipliée par deux chez les patients présentant une insuffisance rénale sévère (voir rubrique Propriétés pharmacocinétiques). Dans la mesure où une dose plus faible de rélugolix n'est pas disponible, la prudence s'impose chez les patients présentant une insuffisance rénale sévère en cas d'administration d'une dose quotidienne de 120 mg de rélugolix en une prise. Les quantités de rélugolix éliminées par hémodialyse ne sont pas connues.
Surveillance du PSA (prostate specific antigen ou antigène prostatique spécifique)
La réponse thérapeutique à Orgovyx doit être évaluée par un examen clinique et le dosage sanguin de l'antigène prostatique spécifique (PSA).
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c'est-à-dire qu'il est essentiellement « sans sodium ».
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment observés pendant le traitement par le rélugolix sont les effets physiologiques de la diminution des taux de testostérone, incluant des bouffées de chaleur (54 %), des douleurs musculo-squelettiques (30 %) et une fatigue (26 %). La diarrhée et la constipation figurent parmi les autres effets indésirables très fréquents (12 % chacun).
Tableau récapitulatif des effets indésirables
Les effets indésirables répertoriés dans le tableau 2 sont classés en fonction de leur fréquence et de la classe de systèmes d'organes. Au sein de chaque groupe de fréquences, les effets indésirables sont présentés par ordre de gravité décroissante. Les fréquences sont définies selon les conventions suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 3. Effets indésirables rapportés dans le cadre des études cliniques et de l'expérience post-commercialisation
| Affections hématologiques et du système lymphatique | |
| Fréquent | Anémie |
| Affections endocriniennes | |
| Fréquent | Gynécomastie |
| Affections psychiatriques | |
| Fréquent | Insomnie |
| Dépression | |
| Affections du système nerveux | |
| Fréquent | Sensations vertigineuses |
| Céphalées | |
| Affections cardiaques | |
| Peu fréquent | Infarctus du myocarde |
| Fréquence indéterminée | Allongement de l'intervalle QT (voir rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions) |
| Affections vasculaires | |
| Très fréquent | Bouffées de chaleur |
| Fréquent | Hypertension |
| Affections gastro-intestinales | |
| Très fréquent | Diarrhéea |
| Constipation | |
| Fréquent | Nausées |
| Affections de la peau et du tissu sous-cutané | |
| Fréquent | Hyperhidrose |
| Rash | |
| Peu fréquent | Urticaire Angiœdème |
| Affections musculo-squelettiques et systémiques | |
| Très fréquent | Douleurs musculo-squelettiquesb |
| Peu fréquent | Ostéoporose/ostéopénie |
| Affections des organes de reproduction et du sein | |
| Fréquent | Diminution de la libido |
| Troubles généraux et anomalies au site d'administration | |
| Très fréquent | Fatiguec |
| Investigations | |
| Fréquent |
Prise de poids |
| Glucose augmentéd | |
| Triglycérides augmentésd | |
| Cholestérolémie augmentéee | |
| Peu fréquent |
Aspartate aminotransférase augmentée |
| Alanine aminotransférase augmentéed | |
a Inclut diarrhées et colite.
b Inclut arthralgies, dorsalgies, douleurs aux extrémités, douleurs musculo-squelettiques, myalgies, douleurs osseuses, cervicalgies, arthrite, raideur musculo-squelettique, douleurs thoraciques non cardiaques, douleurs rachidiennes et gêne musculo-squelettique.
c Inclut fatigue et asthénie.
d Élévations de grades 3/4 identifiées dans les analyses de biologie clinique (voir ci-après).
e Aucune augmentation de la cholestérolémie de grade > 2 n'a été rapportée.
Description d'effets indésirables sélectionnés
Modifications des paramètres biologiques
Les valeurs biologiques observées à un an dans l'étude de phase III (N = 622) entre Orgovyx et un agoniste de la GnRH (leuproréline) utilisé comme comparateur étaient similaires. Des concentrations d'ALAT et/ou d'ASAT supérieures à 3 fois la valeur limite haute ont été rapportées après traitement par Orgovyx chez 1,4 % des patients qui avaient des valeurs normales avant le traitement. Des augmentations des ALAT de grades 3/4 ont été observées chez 0,3 % des patients et des augmentations des ASAT de grades 3/4 ont été observées chez 0 % des patients traités par Orgovyx. Aucun événement n'a été associé à une bilirubine élevée.
À un an, le taux d'hémoglobine a diminué de 10 g/L. Une diminution importante du taux d'hémoglobine (≤ 105 g/L) a été observée chez 4,8 % des patients après traitement par Orgovyx, avec des diminutions de grades 3/4 chez 0,5 % des patients. Des augmentations de grades 3/4 de la glycémie et des triglycérides ont été observées respectivement chez 2,9 % et 2,0 % des patients.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
La réponse thérapeutique à ce traitement doit être évaluée par un examen clinique et le dosage sanguin de l'antigène prostatique spécifique (PSA).
CONTACTER
IMMEDIATEMENT LE MEDECIN en cas de :
- Vertiges, perte de conscience,
sensation que le coeur bat fort ou vite (palpitations) ou douleur
thoracique.
- Gonflement rapide du visage, de la bouche, des lèvres, de la langue, de la gorge, de l'abdomen ou des bras et des jambes.
EVITER toute préparation à base de millepertuis (Hypericum perforatum).
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (sensations vertigineuses).
UTILISER UNE CONTRACEPTION EFFICACE :
- En cas de rapports sexuels avec une
femme susceptible de tomber enceinte (préservatif associé à une autre
méthode de contraception efficace utilisée par la partenaire) pendant
le traitement et pendant deux
semaines après la dernière dose.
- En cas de rapports sexuels avec une
femme enceinte (préservatif) afin de protéger l'enfant à naître.
Ce médicament n'est pas indiqué chez les femmes en âge de procréer. Il ne doit pas être utilisé chez les femmes qui sont enceintes ou susceptibles de l'être ou qui allaitent (voir rubrique Indications thérapeutiques).
Contraception
La présence de rélugolix ou de ses métabolites dans le sperme n'est pas connue. D'après les données observées chez l'animal et le mécanisme d'action du rélugolix, en cas de rapports sexuels avec une femme en âge de procréer, une contraception efficace doit être utilisée pendant le traitement et pendant deux semaines après la dernière dose d'Orgovyx.
Grossesse
Il existe des données limitées sur l'utilisation du rélugolix chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une augmentation possible du risque d'interruption de grossesse précoce en cas d'exposition au rélugolix en début de grossesse (voir rubrique Données de sécurité préclinique). Sur la base des effets pharmacologiques, on ne peut exclure un effet délétère sur la grossesse.
Allaitement
Les études non cliniques rapportent une excrétion de rélugolix dans le lait de rates allaitantes (voir rubrique Données de sécurité préclinique). Aucune donnée n'est disponible sur l'excrétion de rélugolix ou de ses métabolites dans le lait maternel ni sur leurs effets chez les nourrissons allaités. Un risque pour les nouveau- nés/nourrissons allaités ne peut être exclu.
Fertilité
D'après les données observées chez l'animal et son mécanisme d'action, Orgovyx peut diminuer la fertilité chez les hommes susceptibles de procréer (voir rubrique Données de sécurité préclinique).
Effets possibles des autres médicaments sur l'exposition au rélugolix
Des études d'interaction clinique avec des inhibiteurs de la P-gp (érythromycine et azithromycine) et des inducteurs combinés de la P-gp et puissants du CYP3A4 (rifampicine) ont montré qu'ils affectaient l'exposition au rélugolix dans une mesure cliniquement pertinente. Les effets de la co-administration sur l'exposition au rélugolix et les recommandations posologiques associées sont résumés dans le Tableau 1. Cette liste comprend également les effets attendus et les recommandations avec d'autres médicaments susceptibles d'interagir.
Inhibiteurs de la P-gp
L'administration concomitante d'Orgovyx avec des inhibiteurs oraux de la P-gp n'est pas recommandée. Le rélugolix est un substrat de la P-gp (voir rubrique Propriétés pharmacocinétiques).
Si l'administration concomitante avec des inhibiteurs oraux de la P-gp en une ou deux prises par jour est nécessaire, Orgovyx doit être pris en premier, l'inhibiteur de la P-gp devant être pris 6 heures plus tard ; une surveillance plus fréquente des patients visant à déceler les effets indésirables devra alors être mise en place. Il est également possible d'interrompre le traitement par Orgovyx pendant une période allant jusqu'à deux semaines pour un traitement de courte durée par un inhibiteur de la P-gp (p. ex. avec certains antibiotiques de la famille des macrolides). Si le traitement par Orgovyx est interrompu pendant plus de sept jours, il sera nécessaire de reprendre l'administration d'Orgovyx à une dose de charge de 360 mg le premier jour et poursuivre à une dose de 120 mg en une prise par jour (voir rubrique Posologie et mode d'administration).
Inducteurs de la P-gp qui sont également des inducteurs puissants du CYP3A
L'administration concomitante d'Orgovyx avec des inducteurs de la P-gp qui sont également des inducteurs puissants du CYP3A n'est pas recommandée.
Si l'administration concomitante est nécessaire, la dose d'Orgovyx doit être augmentée (voir rubrique Posologie et mode d'administration). Après l'arrêt du traitement par l'inducteur de la P-gp qui est également un inducteur puissant du CYP3A, le traitement par Orgovyx doit être repris à la dose recommandée en une prise par jour.
Autres médicaments
Aucune différence cliniquement significative de la pharmacocinétique du rélugolix n'a été observée lors de l'administration concomitante du rélugolix avec des médicaments visant à diminuer l'acidité.
Compte tenu de la possible prolongation de l'intervalle QT lors du traitement par suppression androgénique, l'utilisation concomitante d'Orgovyx avec des médicaments connus pour allonger l'intervalle QT ou capables d'induire des torsades de pointes comme les antiarythmiques de classe IA (p. ex. quinidine, dysopyramide) ou de classe III (p. ex. amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc. doit être évaluée avec précaution (voir rubrique Mises en garde spéciales et précautions d'emploi).
Tableau 1. Effet des médicaments coadministrés sur l'exposition au rélugolix (Cmax, AUC0-inf) et les recommandations
| Interaction entre les médicaments | Schéma posologique de rélugolix | Modification de l'ASC0-inf du rélugolix | Modification de la Cmax du rélugolix | Recommandations |
| Médicaments qui sont des inhibiteurs de la P gp par voie orale | ||||
|
érythromycine
500 mg quatre fois par jour, doses multiples (P-gp et inhibiteur modéré du CYP3A4) |
120
mg en dose unique |
3,5 fois ↑ | 2,9 fois ↑ |
L'utilisation
concomitante d'Orgovyx avec l'érythromycine, azithromycine et d'autres
inhibiteurs de la P-gp par voie orale n'est pas recommandée. Si l'utilisation concomitante avec des inhibiteurs de la P-gp administrés une ou deux fois par jour par voie orale est nécessaire (par exemple, l'azithromycine), prendre Orgovyx en premier, séparer l'administration de l'inhibiteur de la P-gp d'au moins 6 heures et surveiller les patients plus fréquemment pour détecter les effets indésirables. |
|
azithromycine
500 mg en dose unique (inhibiteur de la P-gp) |
120
mg en dose unique |
*1,5 fois ↑ | *1,6 fois ↑ | |
|
azithromycine
500 mg en dose unique 6 heures après l'administration de rélugolix (inhibiteur de la P-gp) |
1,4 fois ↑ | 1,3 fois ↑ | ||
|
D'autres
médicaments qui sont des inhibiteurs de la P-gp incluent (mais ne sont pas
limités à) : Anti-infectieux : azithromycine, érythromycine, clarithromycine, gentamicine, tétracycline. Agents antifongiques kétoconazole, itraconazole. Antihypertenseurs carvédilol, vérapamil. Antiarythmiques amiodarone, dronédarone, propafénone, quinidine. Agents antiangineux ranolazine Agents immunosupresseurs ciclosporine. Inhibiteurs de la protéase du VIH ou du VHC ritonavir, télaprévir. |
Dose
thérapeutique pour Orgovyx |
Attendu
: ↑ Voir également les résultats des études cliniques avec l'érythromycine et l'azithromycine (ci-dessus). |
Attendu
: ↑ Voir également les résultats des études cliniques avec l'érythromycine et l'azithromycine (ci-dessus). |
|
| Médicaments qui sont des inhibiteurs du CYP3A4 | ||||
|
voriconazole
200 mg deux fois par jour, doses multiples (inhibiteur puissant du CYP3A4) |
120
mg en dose unique |
12% ↑ | 18% ↓ | Aucune modification de la dose n'est recommandée en cas d'administration concomitante de rélugolix et d'inhibiteurs du CYP3A4 sans inhibition de la P-gp. |
|
fluconazole
200 mg quatre fois par jour, doses multiples (inhibiteur modéré du CYP3A4) |
40
mg en dose unique |
19% ↑ | 44% ↑ | |
|
atorvastatine
80 mg quatre fois par jour, doses multiples (inhibiteur léger du CYP3A4) |
40
mg en dose unique |
5% ↓ | 22% ↓ | |
| Médicaments qui sont à la fois des inducteurs de la P gp et des inducteurs puissants du CYP3A4 | ||||
| rifampicine 600 mg quatre fois par jour, doses multiples |
40
mg en dose unique |
55% ↓ | 23% ↓ |
L'administration
concomitante d'Orgovyx avec la rifampicine et d'autres inducteurs puissants
du CYP3A4 et de la P-gp n'est pas recommandée, car cela peut diminuer l'ASC
et la Cmax du rélugolix et donc réduire les effets thérapeutiques
d'Orgovyx. Une augmentation de la dose est recommandée si une co-administration est nécessaire (voir section Posologie et mode d'administration). |
|
Les
médicaments qui sont à la fois inducteur de la P gp et inducteurs puissants
du CYP3A4 comprennent (mais ne sont pas limités à) : Inhibiteur des récepteurs androgéniques apalutamide. Anticonvulsivants : carbamazépine, phénytoïne, phénobarbital. Anti-infectieux rifampicine, rifabutine. Plantes médicinales Millepertuis (Hypericum perforatum). Inhibiteurs de protéase du VIH ou du VHC Ritonavir. Inhibiteurs non nucléosidiques de la transcriptase inverse efavirenz. |
Dose
thérapeutique pour Orgovyx |
Attendu
: ↓ Voir également les résultats des études cliniques avec l'érythromycine et l'azithromycine (ci-dessus). |
Attendu
: ↓ Voir également les résultats des études cliniques avec l'érythromycine et l'azithromycine (ci-dessus). |
|
| Association avec d'autres médicaments pour le traitement du cancer de la prostate hormono-sensible à un stade avancé | ||||
|
Abiratérone
(pas un inhibiteur/inducteur de CYP3A4 et/ou P-gp) |
Dose
thérapeutique pour Orgovyx |
Attendu : ↔ | Attendu : ↔ |
L'abiratérone
et le docétaxel ne sont pas des inhibiteurs/inducteurs connus des enzymes et
des transporteurs contribuant au métabolisme et au transport du rélugolix. Aucune interaction cliniquement significative n'est attendue et aucun ajustement de la dose d'Orgovyx n'est nécessaire. |
|
Docétaxel
(pas un inhibiteur/inducteur de CYP3A4 et/ou P-gp) |
Dose thérapeutique pour Orgovyx | Attendu : ↔ | Attendu : ↔ | |
| Interaction entre les médicaments | Schéma posologique de rélugolix |
Modification
de l 'ASC0-inf du rélugolix |
Modification
de la Cmax du rélugolix |
Recommandations |
|
Darolutamide
(inducteur léger du CYP3A4) |
Dose thérapeutique pour Orgovyx | Attendu : ↔ | Attendu : ↔ |
Le
darolutamide est un faible inducteur du CYP3A4. Cependant, la diminution potentielle de l'exposition ne devrait pas être cliniquement significative. Aucun ajustement de la dose d'Orgovyx n'est nécessaire. |
|
Enzalutamide
(inducteur puissant du CYP3A4 et inhibiteur de la P-gp) |
Dose
thérapeutique pour Orgovyx |
Attendu : ↔ | Attendu : ↔ |
L'enzalutamide
peut diminuer (induction du CYP3A4) et/ou augmenter (inhibition de la P-gp)
l'exposition au rélugolix. Sur la base de données limitées (n=20) chez des hommes ayant reçu une dose de 120 mg de relugolix et des doses de 80 à 160 mg d'enzalutamide de manière concomitante pendant une durée allant jusqu'à 266 jours dans le cadre de l'étude de phase 3, les concentrations plasmatiques minimales de rélugolix n'ont pas changé de manière cliniquement significative lors de l'ajout d'enzalutamide à la monothérapie par rélugolix. Par conséquent, aucune modification de la dose n'est recommandée en cas d'administration concomitante de rélugolix et d'enzalutamide. |
|
Apalutamide
(inducteur P-gp et inducteur puissant du CYP3A4) |
Dose thérapeutique pour Orgovyx | Attendu : ↓ | Attendu : ↓ |
L'administration
conjointe d'Orgovyx et d'apalutamide n'est pas recommandée, car l'apalutamide
est un inducteur combiné de la P-gp et du CYP3A4. Dans une étude clinique, Orgovyx 120 1x/j (sans apalutamide) et Orgovyx 240 1x/j(avec 240 1x/j d'apalutamide) ont donné des valeurs de concentration résiduelle à l'état d'équilibre (Ctrough) similaires. Une augmentation de la dose d'Orgovyx est recommandée en cas de coadministration avec l'apalutamide (voir rubrique Posologie et mode d'administration). |
Abréviations : VIH : virus de
l'immunodéficience humaine, VHC : virus de l'hépatite C.
* : Lors de l'administration concomitante d'azithromycine et de rélugolix, des augmentations de l'exposition au rélugolix allant jusqu'à 5 fois ont été observées dans les 3 premières heures après l'administration dans les courbes médianes de concentration en fonction du temps. Après une fenêtre de séparation des doses de 6 heures, l'augmentation de l'exposition au relugolix dans les courbes médianes de concentration en fonction du temps a été au maximum de 1,6 fois dans les 3 premières heures suivant l'administration.
Effets possibles du rélugolix sur l'exposition à d'autres médicaments
Le rélugolix est un inducteur léger du métabolisme médié par le CYP3A et un inhibiteur de la BCRP et de la P-gp in vitro. Les effets de l'administration concomitante de rélugolix sur l'exposition au midazolam, à la rosuvastatine et au dabigatran, ainsi que les recommandations posologiques associées, sont résumés dans le Tableau 2. Cette liste comprend également les effets d'interaction potentiels attendus du rélugolix sur d'autres médicaments.
Études in vitro
Enzymes du cytochrome P450 (CYP) : le rélugolix n'est pas un inhibiteur du CYP1A2, du CYP2B6, du CYP2C8, du CYP2C9, du CYP2C19, du CYP2D6 ou du CYP3A4 ni un inducteur du CYP1A2 ou du CYP2B6 aux concentrations plasmatiques cliniquement pertinentes.
Transporteurs : le rélugolix n'est pas un inhibiteur des transporteurs OATP1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT2, MATE1, MATE2-K ou BSEP aux concentrations plasmatiques cliniquement pertinentes.
Tableau 2. Effet du rélugolix sur l'exposition (Cmax, AUC0-inf) des médicaments coadministrés et recommandations
| Schéma posologique de rélugolix | Schéma d'administration du médicament | Modification de l'ASC0-inf du médicament | Modification de la Cmax du médicament | Recommandations |
| Médicaments substrats du CYP3A | ||||
|
120
mg 1x/j, doses multiples |
Midazolam
5 mg dose unique (substrat sensible du CYP3A) |
22% ↓ | 14% ↓ |
Aucun
ajustement de la dose de midazolam et d'autres substrats du CYP3A n'est
nécessaire. Des interactions cliniquement significatives avec d'autres substrats du CYP3A que le midazolam ne sont pas attendues. En cas de diminution des effets thérapeutiques, les médicaments (par exemple les statines) peuvent être titrés pour obtenir les effets thérapeutiques souhaités. |
| Médicaments qui sont des substrats de la BCRP | ||||
|
120
mg 1x/j, doses multiples |
Rosuvastatine
10 mg dose unique (substrat sensible de la BCRP et de l'OATP1B1) |
27% ↓ | 34% ↓ | La diminution de l'exposition à la rosuvastatine n'est pas considérée comme cliniquement significative ; cependant, la rosuvastatine peut être titrée pour obtenir les effets thérapeutiques souhaités. L'effet du rélugolix sur d'autres substrats de la BCRP n'a pas été évalué et la pertinence pour d'autres substrats de la BCRP est inconnue. |
|
120
mg en dose unique |
Dabigatran exetilate
150 mg dose unique (substrat de la P- gp) |
17% ↑ | 18% ↑ |
L'augmentation
de l'exposition au dabigatran n'est pas considérée comme cliniquement
significative. Par conséquent, les effets cliniquement significatifs d'une
dose de 120 mg de rélugolix sur d'autres substrats de la P gp ne sont pas
attendus. Étant donné que la dose de charge de 360 mg de relugolix n'a pas été testée, il est conseillé de séparer la dose de charge de rélugolix de l'administration d'autres substrats de la P-gp. |
| Association avec d'autres médicaments pour le traitement du cancer de la prostate hormono-sensible à un stade avancé | ||||
|
Dose
thérapeutique pour Orgovyx |
Abiratérone (substrat du CYP3A4) | Attendu : ↔ | Attendu : ↔ | Aucune modification cliniquement significative de l'exposition n'est attendue et aucun ajustement de la dose n'est nécessaire pour l'abiratérone, l'enzalutamide, l'apalutamide, le darolutamide ou le docétaxel lorsqu'ils sont administrés en même temps que le rélugolix. |
|
Dose
thérapeutique pour Orgovyx |
Docetaxel (substrat du CYP3A) | Attendu : ↔ | Attendu : ↔ | |
|
Dose
thérapeutique pour Orgovyx |
Darolutamide (substrat du CYP3A, de la P-gp et de la BCRP) | Attendu : ↔ | Attendu : ↔ | |
|
Dose
thérapeutique pour Orgovyx |
Enzalutamide (substrat du CYP2C8 et du CYP3A4) | Attendu : ↔ | Attendu : ↔ | |
|
Dose
thérapeutique pour Orgovyx |
Apalutamide (substrat du CYP2C8 et du CYP3A4) | Attendu : ↔ | Attendu : ↔ | |
Le traitement par Orgovyx doit être instauré et supervisé par un médecin spécialiste expérimenté dans le traitement médical du cancer de la prostate.
Posologie
Le traitement par Orgovyx doit être instauré à une dose de charge de 360 mg (trois comprimés) le premier jour et poursuivi à une dose de 120 mg (un comprimé) en une prise par jour à peu près à la même heure chaque jour.
Le rélugolix n'induisant pas de pic de testostérone, il n'est pas nécessaire de prescrire un anti- androgène comme protection contre les pics lors de l'instauration du traitement.
Modification de la posologie lors de l'utilisation avec des inhibiteurs de la P-gp
L'administration concomitante d'Orgovyx avec des inhibiteurs oraux de la glycoprotéine-P (P-gp) n'est pas recommandée. Si l'administration concomitante est nécessaire, Orgovyx doit être pris en premier et un intervalle d'au moins 6 heures doit être respecté avant la prise de l'autre médicament (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Le traitement par Orgovyx peut être interrompu pendant une période allant jusqu'à deux semaines si un traitement de courte durée par un inhibiteur de la P-gp s'avère nécessaire.
Modification de la posologie lors de l'utilisation avec des inducteurs de la P-gp qui sont également des inducteurs puissants du CYP3A
L'administration concomitante d'Orgovyx avec des médicaments à la fois inducteurs de la P-gp et inducteurs puissants du cytochrome P450 (CYP) 3A n'est pas recommandée. Si l'administration concomitante est nécessaire, la dose d'Orgovyx doit être augmentée à 240 mg en une prise par jour. Après l'arrêt du traitement par un médicament à la fois inducteur de la P-gp et inducteur puissant du CYP3A, la dose recommandée de 120 mg d'Orgovyx en une prise par jour doit être reprise (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Oubli de comprimés
En cas d'oubli d'un comprimé, Orgovyx doit être pris dès que le patient s'en rend compte. Si l'oubli de comprimés remonte à plus de 12 heures, le comprimé oublié ne doit pas être pris et le traitement doit être repris le lendemain à l'heure habituelle.
Si le traitement par Orgovyx est interrompu pendant plus de sept jours, il sera nécessaire de reprendre l'administration d'Orgovyx à une dose de charge de 360 mg le premier jour et poursuivre à une dose de 120 mg en une prise par jour.
Populations particulières
Sujets âgés
Aucun ajustement posologique n'est nécessaire chez les sujets âgés (voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. La prudence s'impose chez les patients présentant une insuffisance rénale sévère (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacocinétiques).
Insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacocinétiques).
Population pédiatrique
Il n'existe pas d'utilisation justifiée d'Orgovyx chez les enfants et adolescents âgés de moins de 18 ans dans l'indication du traitement du cancer de la prostate avancé hormonodépendant.
Mode d'administration
Voie orale.
Orgovyx peut être pris au cours ou en dehors des repas (voir rubrique Propriétés pharmacocinétiques). Les comprimés doivent être avalés entiers avec une quantité suffisante de liquide si nécessaire.
Durée de conservation :
3 ans.
Précautions particulières de conservation :
Ce médicament ne nécessite pas de précautions particulières de conservation.
Sans objet.
Il n'existe pas d'antidote spécifique en cas de surdosage par Orgovyx. En cas de surdosage, le traitement par Orgovyx doit être arrêté et des mesures générales de soutien doivent être mises en place jusqu'à ce que tout effet toxique clinique éventuel ait diminué ou soit résolu, en tenant compte de la demi-vie de 61,5 heures. Aucun effet indésirable dans un contexte de surdosage n'a été observé à ce jour ; le cas échéant, ces effets indésirables seraient semblables à ceux répertoriés dans la rubrique Effets indésirables. On ne sait pas si le rélugolix est éliminé par hémodialyse.
Classe pharmacothérapeutique : Hormonothérapie, autres antagonistes hormonaux et agents apparentés, Code ATC : L02BX04
Mécanisme d'action
Le rélugolix est un antagoniste non peptidique des récepteurs de la GnRH qui se lie de manière compétitive aux récepteurs de la GnRH situés dans l'antéhypophyse, empêchant ainsi la liaison de la GnRH native et la transmission du signal de secrétion de l'hormone lutéinisante (LH) et de l'hormone folliculo-stimulante (FSH). Il en résulte une diminution de la production de testostérone par les testicules. Chez l'homme, les concentrations de FSH et de LH diminuent rapidement après l'instauration du traitement par Orgovyx et les concentrations de testostérone chutent pour atteindre des valeurs inférieures aux concentrations physiologiques (seuil de castration). Contrairement aux agonistes de la GnRH, les antagonistes de la GnRH n'induisent pas de pic de LH et FSH, responsable du pic de testostérone/d'une stimulation de la tumeur et d'une possible exacerbation des symptômes (effet « flare up »), après l'initiation du traitement. Après l'arrêt du traitement, les concentrations des hormones hypophysaires et gonadiques retrouvent des valeurs physiologiques.
Efficacité et sécurité cliniques
L'efficacité et la sécurité d'Orgovyx ont été évaluées dans l'étude HERO, une étude randomisée en ouvert menée chez des hommes adultes atteints d'un cancer de la prostate avancé hormonodépendant nécessitant un traitement par suppression androgénique pendant au moins un an et qui étaient non éligibles à la chirurgie ou à la radiothérapie à visée curative. Les patients éligibles à l'étude présentaient des signes de récidive biochimique (PSA) ou clinique après une intervention primaire localisée à visée curative et n'étaient pas éligibles à une chirurgie de rattrapage, présentaient un cancer métastatique hormonodépendant nouvellement diagnostiqué ou un cancer localement avancé peu susceptible d'être guéri par une intervention primaire par chirurgie ou radiothérapie. Les patients éligibles à l'étude devaient avoir un indice fonctionnel ECOG (Eastern Cooperative Oncology Group) de 0 ou 1. Les patients dont la maladie progressait pendant la période de traitement ont été encouragés à rester dans l'étude et, si cela était indiqué, ils pouvaient recevoir une radiothérapie comme prescrit par l'investigateur. En cas d'augmentation des taux de PSA, les patients étaient autorisés à recevoir de l'enzalutamide après confirmation de la progression du taux de PSA ou bien du docétaxel pendant l'étude.
Le critère principal d'efficacité était le taux de castration médicale définie comme l'obtention et le maintien d'une diminution de la testostéronémie à des taux de castration (< 50 ng/dL) au jour 29 et jusqu'à la semaine 48 de traitement ; la non-infériorité du rélugolix par rapport à la leuproréline a également été évaluée (voir le tableau 3). Les autres critères secondaires principaux incluaient les taux de castration aux jours 4 et 15, les taux de castration avec une testostéronémie < 20 ng/dL au jour 15 et le taux de diminution du PSA au jour 15 (voir le tableau 4).
Au total, 934 patients ont été randomisés selon un rapport de 2:1 pour recevoir Orgovyx ou la leuproréline pendant 48 semaines :
a) Orgovyx à une dose de charge de 360 mg le premier jour puis à des doses de 120 mg par jour par voie orale.
b) Leuproréline en injections sous-cutanées de 22,5 mg (ou 11,25 mg au Japon, à Taïwan et en Chine) tous les 3 mois.
L'âge médian de la population (N = 930) pour les deux groupes de traitement était de 71 ans (de 47 à 97 ans). Les groupes ethniques étaient répartis ainsi : Caucasiens 68 %, Asiatiques 21 %, Noirs 4,9 %, Autres 5 %. Les stades tumoraux étaient répartis de la façon suivante : tumeur métastatique (M1) 32 %, tumeur localement avancée (T3/4 NX M0 ou toute tumeur T N1 M0) 31 %, tumeur localisée (T1 ou T2 N0 M0) 28 % et tumeur inclassifiable 10 %.
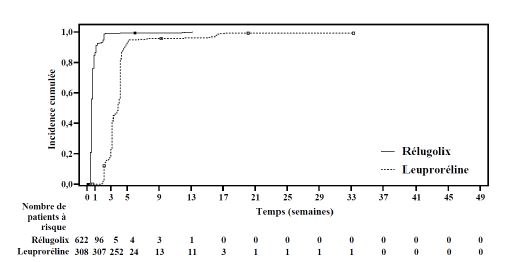
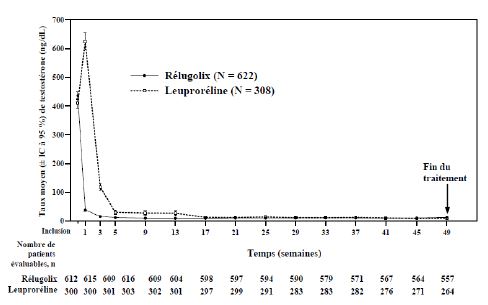
Les résultats du critère principal d'efficacité d'Orgovyx comparé à la leuproréline pour l'obtention et le maintien de la testostéronémie à des taux de castration (testostéronémie < 50 ng/dL) sont présentés dans le tableau 3 et la figure 1. Les taux de testostérone à l'inclusion et l'évolution au cours du temps de la diminution du taux de testostérone par Orgovyx et par la leuproréline pendant les 48 semaines de la période de traitement sont présentées dans la figure 2.
Tableau 4. Taux de castration médicale (testostéronémie < 50 ng/dL) du jour 1 de la semaine 5(jour 29) au jour 1 de la semaine 49 (jour 337) dans l'étude HERO
| Orgovyx 360/120 mg | Leuproréline 22,5 ou 11,25 mga | |
| Nombre de patients traités | 622b | 308b |
| Taux de répondeurs (IC à 95 %)c | 96,7 % (94,9 % ; 97,9 %) | 88,8 % (84,6 % ; 91,8 %) |
| Différence avec la leuproréline (IC à 95 %) | 7,9 % (4,1 % ; 11,8 %)d Valeur p < 0,0001 |
a
Dose de 22,5 mg en Europe et en Amérique du Nord ; dose de 11,25 mg en
Asie. Le taux de castration du sous-groupe de patients recevant 22,5 mg
de leuproréline (n = 264) était de 88,0 % (IC à 95 % : 83,4 % ; 91,4 %).
b Deux patients dans chaque groupe n'ont pas reçu le traitement expérimental et n'ont pas été inclus.
c Estimations de Kaplan-Meier intragroupe.
d La non-infériorité a été testée avec une marge de -10 %.
b Deux patients dans chaque groupe n'ont pas reçu le traitement expérimental et n'ont pas été inclus.
c Estimations de Kaplan-Meier intragroupe.
d La non-infériorité a été testée avec une marge de -10 %.
Figure 1 : Incidence cumulée des taux de testostérone < 50 ng/dL dans l'étude HERO
Figure 2 : Taux de testostérone entre l'inclusion et la semaine 49 (moyenne et IC à 95 %) dans l'étude HERO
Le tableau 4 présente une synthèse des résultats des principaux critères secondaires.
Tableau 5. Synthèse des principaux critères secondaires| Critère secondaire | Orgovyx (N = 622) | Leuproréline (N = 308) | Valeur p |
| Probabilité cumulée de diminution de la testostéronémie à < 50 ng/dL avant la dose du jour 4 | 56,0 | 0,0 | < 0,0001 |
| Probabilité cumulée de diminution de la testostéronémie à < 50 ng/dL avant la dose du jour 15 | 98,7 | 12,1 | < 0,0001 |
| Proportion de patients présentant une diminution du PSA au jour 15 suivie d'une confirmation au jour 29 | 79,4 | 19,8 | < 0,0001 |
| Probabilité cumulée de diminution de la testostéronémie à < 20 ng/dL avant la dose du jour 15 | 78,4 | 1,0 | < 0,0001 |
Abréviations : PSA = antigène prostatique spécifique.
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec Orgovyx dans tous les sous-groupes de la population pédiatrique dans le traitement du cancer de la prostate avancé hormonodépendant (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Après administration orale d'une dose de charge unique de 360 mg, les moyennes (± écarts-types [± ET]) de l'ASC0-24 et de la Cmax du rélugolix étaient respectivement de 985 (± 742) ng.h/mL et de 215 (± 184) ng/mL. Après administration d'une dose de 120 mg en une prise par jour, les moyennes (± ET) de la Cmax, de la Cmoy (concentration plasmatique moyenne sur un intervalle de 24 heures entre deux administrations) et de la Crésiduelle du rélugolix à l'état d'équilibre étaient respectivement de 70 (± 65) ng/mL, de 17,0 (± 7) ng/mL et de 10,7 (± 4) ng/mL.
L'accumulation de l'exposition au rélugolix lors de l'administration quotidienne d'une dose de 120 mg de rélugolix en une prise est approximativement multipliée par 2. Le schéma d'administration du rélugolix, une dose de charge de 360 mg le premier jour suivie d'une dose quotidienne de 120 mg en une prise, permet d'obtenir l'état d'équilibre au 7ème jour.
Absorption
L'absorption du rélugolix après administration orale est principalement médiée par la P-gp intestinale, dont le rélugolix est un substrat. Après administration orale, le rélugolix est rapidement absorbé, atteignant une concentration quantifiable 0,5 heure après la prise, suivie d'un ou de plusieurs pics d'absorption. Le délai médian (plage) pour atteindre la Cmax (tmax) du rélugolix est de 2,25 heures (0,5 à 5,0 heures). La biodisponibilité absolue du rélugolix est de 11,6 %.
Après administration d'une dose unique de 120 mg de rélugolix après la consommation d'un repas hypercalorique riche en graisses (environ 800 à 1 000 calories dont 500 calories, 220 calories et 124 calories respectivement provenant des graisses, des glucides et des protéines), l'ASC0-∞ et la Cmax avaient diminué respectivement de 19 % et 21 %. Les diminutions d'exposition au rélugolix avec les aliments ne sont pas considérées comme cliniquement significatives et, par conséquent, Orgovyx peut être pris au cours ou en dehors des repas (voir rubrique Posologie et mode d'administration).
Distribution
Le taux de liaison du rélugolix aux protéines plasmatiques est compris entre 68 et 71 %. Il est essentiellement lié à l'albumine et, dans une moindre mesure, à l'α1-glycoprotéine acide. Le ratio sang/plasma moyen est de 0,78. Sur la base du volume de distribution apparent (Vz), la distribution tissulaire du rélugolix est importante. Le volume de distribution estimé à l'état d'équilibre (Vss) est de 3 900 L.
Biotransformation
Les études in vitro montrent que les principales enzymes du CYP impliquées dans le métabolisme oxydatif global du rélugolix au niveau hépatique sont le CYP3A4/5 (45 %) > le CYP2C8 (37 %) > le CYP2C19 (< 1 %), les métabolites oxydatifs produits étant le métabolite-A et le métabolite-B, respectivement par le CYP3A4/5 et le CYP2C8.
Élimination
Après absorption, environ 19 % du rélugolix sont éliminés dans les urines sous forme de substance active inchangée et environ 80 % sont éliminés via différentes voies de biotransformation, y compris les voies du CYP3A et du CYP2C8 et plusieurs autres voies métaboliques mineures, avec une contribution mineure provenant de la sécrétion biliaire du médicament sous forme inchangée et/ou des métabolites. Environ 38 % de la dose administrée sont excrétés sous forme de métabolites (autres que le métabolite-C) dans les fèces et les urines. Le métabolite-C, produit par la flore intestinale, est le principal métabolite présent dans les fèces (51 %) et reflète également le médicament non absorbé.
Linéarité/non-linéarité
Le rélugolix est associé à des augmentations de l'exposition plus que proportionnelles à la dose, à des doses inférieures à 80 mg environ, ce qui est cohérent avec la saturation dose-dépendante de la P-gp intestinale et avec la diminution correspondante de la contribution de l'efflux par la P-gp intestinale pour la biodisponibilité orale du rélugolix à mesure que la dose est augmentée. Lorsque la P-gp intestinale est saturée, une proportion plus élevée de l'absorption du rélugolix est soumise à la diffusion passive et l'exposition au rélugolix augmente proportionnellement à la dose sur un niveau de doses comprises entre 80 et 360 mg. La saturation de la P-gp intestinale avec des doses plus élevés de rélugolix est démontrée par les augmentations dose-dépendante de l'exposition au rélugolix associé à l'érythromycine, un inhibiteur puissant de la P-gp (et un inhibiteur modéré du CYP3A), où les augmentations de l'exposition étaient moindres pour une dose de 120 mg par rapport aux doses plus faibles de rélugolix (20 ou 40 mg) (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Populations particulières
L'analyse pharmacocinétique de population et l'analyse pharmacocinétique/pharmacodynamique de population laissent supposer qu'il n'existe pas de différences cliniquement significatives de l'exposition au rélugolix ou des taux de testostérone en fonction de l'âge, de l'appartenance ethnique, de la corpulence (poids ou indice de masse corporelle) ou du stade du cancer.
Insuffisance rénale
Sur la base des études portant spécifiquement sur l'insuffisance rénale menées avec le rélugolix à la dose de 40 mg, l'exposition au rélugolix (ASC0-t) avait augmenté de 1,5 fois chez les patients présentant une insuffisance rénale modérée et jusqu'à 2 fois chez les patients présentant une insuffisance rénale sévère par rapport aux sujets ayant une fonction rénale normale. Les augmentations chez les patients présentant une insuffisance rénale modérée ne sont pas considérées comme cliniquement significatives. Chez les patients présentant une insuffisance rénale sévère, la prudence s'impose lors de l'administration de doses de 120 mg de rélugolix en une prise par jour (voir rubrique Mises en garde spéciales et précautions d'emploi).
L'effet de l'insuffisance rénale terminale avec ou sans recours à l'hémodialyse sur la pharmacocinétique du rélugolix n'a pas été évalué. La quantité de rélugolix éliminée par hémodialyse est inconnue.
Insuffisance hépatique
Après administration d'une dose unique de 40 mg de rélugolix à des patients présentant une insuffisance hépatique légère ou modérée, l'exposition totale au rélugolix (ASC0-∞) était diminuée de 31 % ou était comparable, respectivement, par rapport aux sujets ayant une fonction hépatique normale. La demi-vie d'élimination moyenne du rélugolix chez les patients présentant une insuffisance hépatique légère ou modérée était comparable à celle observée chez les sujets sains du groupe témoin.
Aucun ajustement posologique d'Orgovyx n'est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée (voir rubrique Posologie et mode d'administration). Les effets de l'insuffisance hépatique sévère sur la pharmacocinétique du rélugolix n'ont pas été évalués.
Orgovyx n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Toutefois, des effets indésirables très fréquents tels que la fatigue et fréquents comme les sensations vertigineuses ont été rapportés avec le rélugolix et peuvent influer sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité et cancérogénèse n'ont pas révélé de risque particulier pour l'homme en dehors de ceux mentionnés ci-après.
Chez la souris mâle knock-in exprimant le récepteur de la GnRH humain, l'administration orale de rélugolix a entraîné une diminution du poids de la prostate et des vésicules séminales à des doses ≥ 3 mg/kg en deux prises par jour pendant 28 jours. Les effets du rélugolix étaient réversibles, sauf sur le poids des testicules qui n'a pas été récupéré complètement dans les 28 jours suivant la fin du traitement. Il est probable que ces effets sur la souris mâle knock-in soient associés à la pharmacodynamique du rélugolix ; cependant, la pertinence de ces résultats chez l'homme n'est pas connue. Lors d'une étude de toxicité à doses répétées d'une durée de 39 semaines menée chez des singes, aucun effet significatif n'a été observé sur les organes de reproduction mâles à des doses orales de rélugolix allant jusqu'à 50 mg/kg/jour (environ 36 fois l'exposition humaine à la dose recommandée de 120 mg par jour sur la base de l'ASC). Le rélugolix (à des doses ≥ 1 mg/kg) a diminué les concentrations de LH chez des singes cynomolgus mâles castrés ; cependant, l'effet suppresseur du rélugolix sur la LH et les hormones sexuelles n'a pas été évalué dans l'étude de toxicité de 39 semaines chez des singes non castrés. Par conséquent, la pertinence pour l'homme de l'absence d'effet sur les organes de la reproduction de singes mâles non castrés n'est pas connue.
Chez les lapines gestantes ayant reçu des doses orales de rélugolix pendant la période d'organogenèse, des avortements spontanés et une perte de toute la portée ont été observés à des niveaux d'exposition (ASC) inférieurs à ceux obtenus en clinique à la dose humaine recommandée de 120 mg/jour. Aucun effet sur le développement embryo-fœtal n'a été observé chez les rats ; cependant, le rélugolix n'interagit pas de façon significative avec les récepteurs de la GnRH dans cette espèce.
Chez les rates allaitantes ayant reçu une dose orale unique de 30 mg/kg de rélugolix radiomarqué au jour 14 post-partum, le rélugolix et/ou ses métabolites étaient présents dans le lait à des concentrations pouvant atteindre 10 fois la concentration plasmatique deux heures après l'administration, avec une diminution à des taux faibles dans les 48 heures suivant la prise. La majorité de la radioactivité retrouvée dans le lait provenait du rélugolix sous forme inchangée.
Les études portant sur l'évaluation du risque environnemental ont montré que le rélugolix peut entraîner un risque pour le milieu aquatique (voir rubrique Précautions particulières d'élimination et de manipulation).
Ce médicament peut entraîner un risque pour le milieu aquatique (voir rubrique Données de sécurité préclinique). Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Prescription initiale hospitalière annuelle.
Prescription initiale réservée à certains spécialistes.
Prescription réservée aux spécialistes et services
CANCEROLOGIE.
Prescription réservée aux spécialistes et services ONCOLOGIE
MEDICALE.
Renouvellement non restreint.
Comprimé pelliculé.
Comprimé
pelliculé rouge clair en forme d'amande (11 mm [de long] × 8 mm [de
large]) portant les mentions « R » sur une face et « 120 » sur l'autre
face.
Les comprimés pelliculés d'Orgovyx sont présentés dans un flacon. Chaque flacon en polyéthylène haute densité (PEHD) contient 30 comprimés pelliculés et un agent déshydratant et est fermé par un bouchon en polypropylène (PP) doté d'une sécurité enfant et scellé par induction.
Conditionnement en flacon de 30 comprimés pelliculés.
Chaque comprimé pelliculé contient 120 mg de rélugolix.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Mannitol (E421)
Carboxyméthylamidon sodique (E468)
Hydroxypropylcellulose (E463)
Stéarate de magnésium (E572)
Hypromellose (E464)
Dioxyde de titane (E171)
Oxyde de fer rouge (E172)
Cire de carnauba (E903)